Un médico toma un suero de AstraZeneca en el centro de vacunación instalado en el WiZink Center de Madrid
Por qué Europa validó la vacuna covid de AstraZeneca y ahora la retira tras millones de pinchazos
Estanislao Nistal, virólogo y profesor de Microbiología de la Facultad de Farmacia de la Universidad San Pablo CEU, apunta a El Debate datos clave
AstraZeneca admite que sus vacunas contra la covid pueden causar efectos secundarios poco comunes
Miles de docentes con las dosis contra la covid suspendidas, un militar muerto, coágulos en la sangre... tras inocular más de 3.000 millones de dosis en todo el mundo (diez de ellos en España), la Comisión Europea ha ordenado eliminar todas las vacunas contra la covid de la farmacéutica inglesa AstraZeneca por sus graves efectos secundarios. A día de hoy existen muchas preguntas con respecto a las vacunas, pero la más valiosa es: ¿por qué la Agencia Europea de Medicamentos aprobó esas inoculaciones y ahora las retira?
En 2020, tras varios meses luchando contra un virus desconocido, las compañías se adentraron en una carrera para lograr sacar un antídoto y paliar así todos los daños que estaba causando este nuevo patógeno.
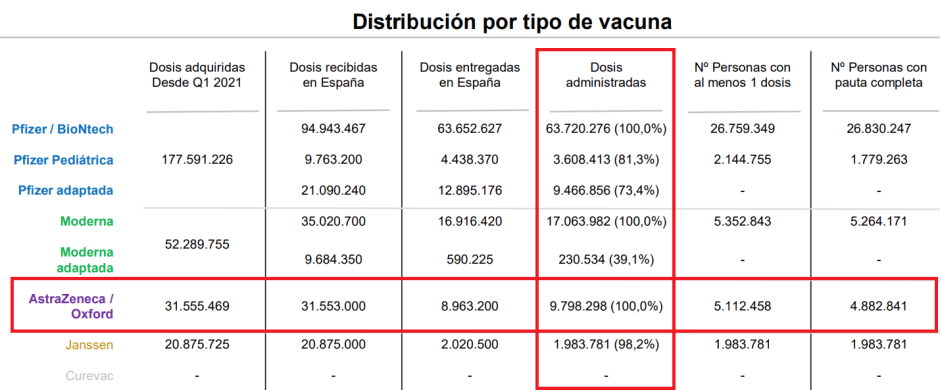
Número de vacunas covid administradas de cada marca hasta julio de 2023. De AstraZeneca se inocularon casi 10 millones y había casi cinco con la pauta completa
Meses después, en enero de 2021, AstraZeneca, una empresa especializada en el descubrimiento, desarrollo y comercialización de medicamentos bajo prescripción médica, se alió con la Universidad de Oxford y creó la que se conocería como Vaxzevria - Vacuna COVID-19 (ChAdOx1-S [recombinante]). Una de las grandes promesas contra la covid en un momento de incertidumbre.
AstraZeneca ya pidió la retirada de las dosis el pasado 5 de marzo
Tras el anuncio de Bruselas, Sandra Gallina, directora general de Salud y Seguridad Alimentaria de la Comisión Europea, ha explicado mediante un comunicado que AstraZeneca ya pidió la retirada de las dosis el pasado 5 de marzo. Sin embargo, a pesar de la importancia por los casos de trombosis con síndrome de trombocitopenia, una enfermedad que hace que la sangre comience a coagularse y las plaquetas comiencen a disminuir, no se han retirado hasta este martes.
Con respecto a las vacunas contra la covid, hay muchas preguntas sin resolver, pero ¿por qué la EMA dio luz verde a esta vacuna si desde el primer momento se estaban experimentando efectos secundarios? Estanislao Nistal, virólogo y profesor de Microbiología de la Facultad de Farmacia de la Universidad San Pablo CEU, ha apuntado a El Debate datos clave.
Tres fases para aprobar un medicamento
En primer lugar, comenta el experto, para aprobar un medicamento hay que tener en cuenta «las tres fases del ensayo clínico».
Así, determina, el punto uno de la EMA fue escoger a cientos o miles personas. Aquí, «si nos enfocamos en las vacunas», razona el profesor y doctor, los datos permitieron validar o determinar si aquello que se iba a inyectar a los pacientes «tenía toxicidad». En este grupo estarían los síntomas leves como el cansancio, el dolor muscular u otros síntomas leves.
En aquel momento lo que ocurrió con las dosis de AstraZeneca es que los problemas de trombosis no se pudieron determinar, ya que «no fueron generalizados», por lo menos en el tiempo durante el cual se valoró la fase ensayo clínico uno. El número de personas que participaron en esa fase «no era suficiente como para determinarlo de una manera fehaciente».
En la fase de ensayo clínico dos, la EMA investigó si la vacuna producía una inmunidad frente al virus desconocido. Aquí, trataron de demostrar si realmente producía anticuerpos neutralizantes si seguía teniendo seguridad. Sabiendo estas dos cosas, entró en juego la fase tres. La definitiva.
En este último tramo necesitaron miles de personas para comprobar todos los puntos de la vacuna. Aquí lo que buscaron, comenta el virólogo Nistal, era que esta «protegiese contra la infección». A priori parecía que sí.
Para llevar esto a cabo, las personas que participaron en el estudio tenían síntomas de poder estar infectadas. Los pasos que siguieron fueron los siguientes: se les realizó una PCR para comprobar si tenían el virus. Tras esto, pincharon las dosis a un número determinado de personas y un placebo a otro. Cuando llegaron al objetivo se levantó el ciego –las personas ya sabían si se habían vacunado o no–. En ese momento vieron el porcentaje de las personas enfermas que no tenían la dosis. En el restante estaban las vacunadas. Aquí se determinó la eficacia del antídoto.
AstraZeneca pasó todas las fases de ensayo, pero algo falló. Los efectos graves se comenzaron a dar a medio-largo plazo. En este sentido, el virólogo y profesor de Microbiología revela que los ensayos clínicos también tienen fase cuatro. «Una vez se cumplieron los objetivos fijados en las tres anteriores», explica, recabaron los datos de las personas que se habían inoculado esa vacuna.
Al hilo, asevera, no solo pasa con este fármaco, sino que también se puede dar «en el resto de medicamentos». Así, recuerda que en el caso de que se den es necesario «hacerlos públicos». Esto es lo que ha pasado con la farmacéutica.
¿Tendremos todos trombosis?
Ya han pasado cuatro años y para ver por qué se puede producir esta afección en pacientes vacunados habría que hacer un estudio específico muy grande en el que se metieran vacunados y no vacunados, ya que hay muchas casuísticas que pueden afectar las trombosis. Tras esto, habría que ver si hay algún tipo de relación a corto, medio y largo plazo. Pero decirlo así, libremente, es bastante aventurado, asegura, por el hecho de que en cuatro años puede acelerarse un proceso trombótico asociado a muchísimas cosas. Por ejemplo, el colesterol o la edad.
«Sin embargo, hay algo que sí se podría hacer», reconoce. De todos los datos que ha ido recolectando la EMA y la Administración de Medicamentos y Alimentos de Estados Unidos (FDA) se podría ejecutar un estudio para ver si los que comenzaron a desarrollar los síntomas estaban más predispuestos a desarrollar esas trombosis.
Por otro lado, propone, con todos los casos que se habrán dado en todo el mundo, podrían llevar a cabo «un estudio multicéntrico de los países para ver cuántas personas se vacunaron con esta vacuna» y los efectos reales que surgieron al respecto. Aun así, reconoce, es «complicadísimo».