Enfermedad de Crohn
Este es el nuevo medicamento que Europa recomienda aprobar para tratar la enfermedad de Crohn
Fue aprobado previamente en la Unión Europea, EE.UU. y Japón en 2023 como tratamiento de primera línea para adultos con colitis ulcerosa
La empresa farmacéutica Lilly ha anunciado este miércoles que el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) ha emitido una opinión positiva para un tratamiento de adultos con enfermedad de Crohn de moderada a grave que hayan tenido una respuesta inadecuada o sean intolerantes a la terapia convencional o a un tratamiento biológico.
En concreto, se trata del mirikizumab, un antagonista de la interleucina-23 (IL-23) que se dirige selectivamente a su subunidad p19 inhibiendo la vía de IL-23.
Tras el hallazgo, el doctor Stefan Schreiber, director de la Clínica de Medicina Interna I del Campus de Kiel del Hospital Universitario de Schleswig-Holstein, en Kiel (Alemania), ha afirmado estar emocionado por el potencial de este tratamiento como nueva opción terapéutica para los pacientes con enfermedad de Crohn de moderada a grave, ya que la mayoría de ellos no alcanzan «la remisión con las terapias actuales o no pueden mantenerla a largo plazo».
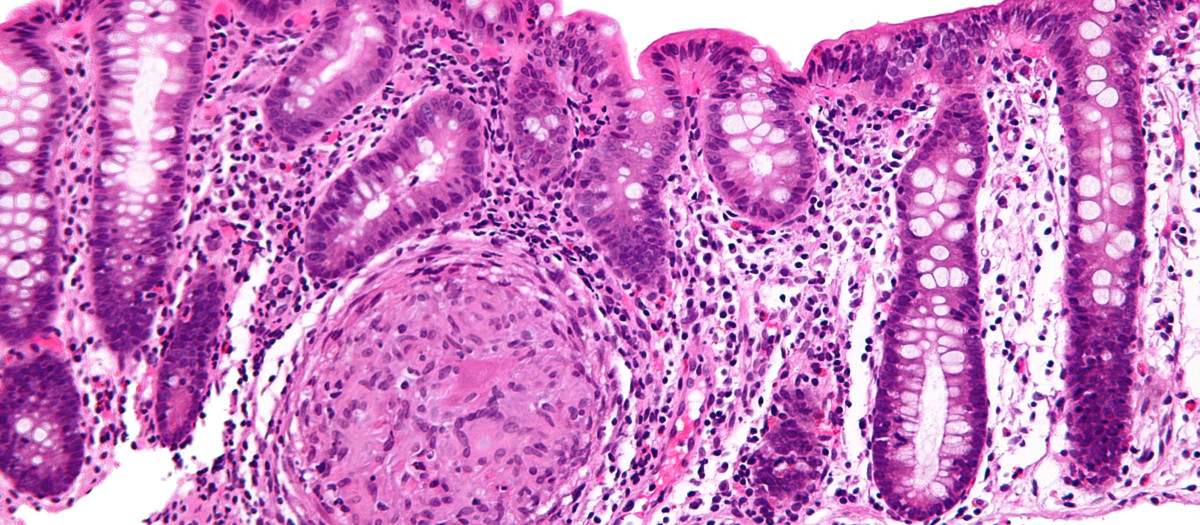
«Asimismo, ha asegurado que con mirikizumab, muchos pacientes pueden lograr un control integral de su enfermedad, incluido «la mejora de síntomas incapacitantes» como la urgencia defecatoria y el control de la inflamación intestinal definida por una curación endoscópica e histológica evidente.
Mirikizumab fue aprobado previamente en la Unión Europea, EE.UU. y Japón en 2023 como tratamiento de primera línea para adultos con colitis ulcerosa de moderada a grave y está aprobado en 44 países de todo el mundo. Esta opinión positiva marca el siguiente paso hacia la aprobación regulatoria europea de este fármaco para pacientes con enfermedad de Crohn de moderada a grave, y ahora se remite a la Comisión Europea para su acción final. La decisión de la Comisión Europea se espera en los próximos uno o dos meses.
El dictamen positivo del CHMP está respaldado por los datos del estudio de fase 3 VIVID-1, que evaluó la seguridad y eficacia de mirikizumab en comparación con placebo y un control activo (ustekinumab) en adultos con esta patología.
Por último, el doctor Mark Genovese, vicepresidente senior de Desarrollo de Inmunología de Lilly, ha explicado que dada la eficacia que se observó en la remisión clínica y la respuesta endoscópica, combinada con las mejoras en la urgencia defecatoria y la inflamación histológica, esta opinión positiva del CHMP para mirikizumab les hace avanzar un paso más hacia «la atención de más personas con enfermedad inflamatoria intestinal en todo el mundo».